HORMONA ANTIMÜLLERIANA - HAM O AMH ¿QUÉ HAY DE NUEVO?
01.01.1970
Algunos conceptos presentados en el Simposio del Congreso de SAEGRE 2018: Nuevos aportes del laboratorio endócrino – ginecológico en el embarazo.
Embarazo en edad materna avanzada: “Utilidad de la determinación de Hormona Antimülleriana (AMH) como marcador de reserva ovárica”.
Dra. Cecilia Zylbersztein (Parte 1)
La AMH es producida por las células de la granulosa de los folículos en crecimiento hasta los antrales pequeños (6-8 mm). Sus valores aumentan progresivamente desde la infancia hasta la adolescencia media alcanzando en promedio 4,7 ng/ml alrededor de los 25 años, momento a partir del cual disminuye con gran variabilidad individual hasta ser no detectable en la menopausia. Los valores de AMH correlacionan con el pool de folículos en crecimiento, siendo proporcional al recuento pequeños Folículos Antrales (FA) en la fase folicular temprana y con el contenido de Folículos Primordiales. Este es el motivo por el cual se considera a la AMH como el mejor Marcador Bioquímico de Reserva Ovárica (RO). der Schouw, Broekmans y cols. en 2016 describieron la concentración de AMH (ng/ml) mediana y rango de acuerdo a la edad de las mujeres (décadas) : 20 años: 3.86 (2.66-5.28); 30 años: 2.81(1.88-4.86); 40 años: 0.93 (0.40-2.0) y 50 años: 0.01 (0.0- 0.08). Esta última es la promedio en que se alcanza la menopausia.
Recientemente, La Marca A. et al. (Fertil Steril 2017), encontraron en pacientes incorporadas a procedimientos de reproducción asistida, independientemente de su edad, una fuerte relación positiva entre su nivel de AMH y la tasa de blastocistos euploidales, reafirmando la relevancia de su medición.
Conceptos Útiles en la Práctica Clínica en función de la reformulación de los paradigmas en la medición de AMH y su estabilidad en distintas situaciones fisiológicas.
Es estable la AMH durante el ciclo menstrual?
En 2012 Overbeek A, Broekmans FJ, van Disseldorp J, Lambalk CB et al. publicaron: “Intra-cycle fluctuations of anti-Müllerian hormone in normal women with regular cycle: a re- analysis”)
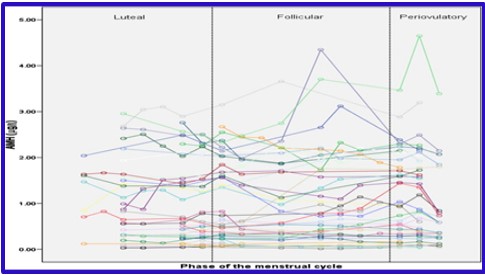
Describen que las concentraciones de AMH muestran grandes fluctuaciones a través del ciclo menstrual, sin seguir un patrón definido. Estas fluctuaciones no se observaron en pacientes con bajos niveles de AMH, en cambio fueron significativas en las pacientes con valores más altos (mayores de 1 ng/ml) (mujeres jóvenes). Conceptos a tener en cuenta con una sola medición de AMH tomada al azar.
Cómo influye el uso de los Anti Conceptivos Orales (ACO) en los valores de AMH ?
JLBentzen JG, Forman y col. en Biom. Online 2012 Dec;25(6): 612/19 “Ovarian reserve parameters: a comparison between users and non-users of hormonal contraception”
Este estudio cuantificó el efecto de la anticoncepción hormonal (ACO) sobre los marcadores de reserva ováricos tanto endocrinos como ecográficos en 228 usuarias y 504 no usuarias. Se evaluó AMH el día 2-5 del ciclo menstrual o durante la hemorragia por deprivación, conjuntamente con la ecografía transvaginal. Después de ajustar por edad, se observó que las tratadas con ACO tenía 29.8 % menos AMH, 30.4 % menor Número de Folículos Antrales (NFA) y Volumen Ovárico disminuyó un 42.2 % respecto del grupo control sin ACO. “Estos efectos se incrementan con el uso prolongado de los mismos” y la recuperación ovárica al interrumpir el uso es variable en cada paciente y puede demorar en algunos casos, alrededor de dos meses.” Postulan que la AMH y el NFA pueden no conservar su precisión como predictores de la reserva ovárica en mujeres usuarias de ACO. Petersen KB . y col 2016 Observan en las usuarias de ACO una disminución significativa en folículos antrales de 5-7 y 8-10 mm de tamaño y un aumento en el número de folículos pequeños de 2-4 mm de tamaño. Plantean que se debe conocer el impacto del uso de ACO en los parámetros de reserva ovárica, al evaluar la fertilidad y estimar la vida reproductiva en sus usuarias. “Importante para evitar caracterizarlas con posible insuficiencia ovárica prematura”.
Impacto del Embarazo en los valores de AMH
En los primeros estudios respecto del tema, La Marca A,& Volpe A. Hum Rep. 2005. Compararon los valores AMH de mujeres normales no gestantes con embarazadas de los tres trimestres y en el puerperio. Los grupos estaban conformados por pacientes entre 18 a 37 años según los grupos. Las concentraciones de AMH no resultaron con diferencias significativas entre los grupos.
Weghofer, A.et al. Reprod.Biol.and End.2011.”Anti-Mullerian hormone levels decline under hormonal suppression: a prospective analysis in fertile women after delivery.” Comparan los valores de AMH de pacientes no embarazadas con embarazadas en los tres trimestres y post parto en tres grupos etarios (años), de 18-30, 31-36 y de 37-40. Observaron que la AMH disminuye durante la gestación en los tres grupos etarios proporcionalmente a la edad. Evaluaron el tiempo de recuperación del valor de AMH post parto así como también el de retomar la menstruación. Se observó que tanto la AMH como retomar la menstruación demoró más tiempo en los grupos de pacientes de mayor edad. En todos los casos, los valores de AMH son menores respecto su grupo etario sin embarazo. Posiblemente la elevación de Progesterona prolongada durante el embarazo, suprima el reclutamiento folicular inicial, preservando así su desarrollo. D.Dewailly et.al 2014 Hum.Repr. Plantea en su revisión que las variaciones de AMH reportadas deben tenerse en cuenta en la interpretación de la práctica clínica. a) AMH fluctúa en el ciclo menstrual, b) La supresión ovárica inducida por intervenciones fisiológicas (embarazo) o farmacológicas (ACO), reducen los niveles de AMH. Lo cual se sugiere esperar entre 2 a 3 meses para volver a evaluar. c) Respecto de las pacientes con poliquistosis de ovario (PCO), estas tienen valores de AMH significativamente más elevados 3 a 4 veces, que su grupo etario. Ya en 2011 D.Dewailly postuló que un valor de “AMH mayor de 5 ng/ml es un marcador más sensible y específico que el recuento 19 Folículos Antrales por ovario para el diagnóstico de PCO o SOP, proponiendo que debe incluirse este concepto en la actual clasificación diagnóstica de SOP. Este aspecto puede servir para explicar no sólo la anovulación sino también la mayor receptividad al estímulo gonadotrófico y el mayor riesgo de síndrome de hiper-estimulación ovárica (SHO) en estas pacientes con PCO.
Esta comunicación se presenta en virtud de actualizar preconceptos que surgieron de las primeras publicaciones sobre AMH como marcador de reserva ovárica. Se consideraba que sus valores se mantenían estables durante todo el ciclo menstrual, no se modificaban por la acción de los ACO y tampoco durante el embarazo. Estos nuevos conocimientos son necesarios para evaluar la reserva ovárica a pacientes que hayan perdido un embarazo recientemente, estuvieran bajo ACO o los hubiera suspendido recientemente. En las publicaciones actuales, las muestras se obtienen en los primeros días del ciclo. En la práctica clínica se aconseja lo mismo, a no ser que la paciente está en amenorrea, no tenga útero o por razones personales que ella manifieste.
Respecto de pacientes con PCO, en el próximo informe (Parte 2), se ampliará la fisiología de éste grupo y sus implicancias clínicas.
